PATOLOGÍAS
Hipomagnesemias primarias
Hipomagnesemia aislada autosómica dominante, tipo Glaudemans
Hipomagnesemia primaria autosómica dominante con hipocalciuria
Hipomagnesemia primaria con discapacidad intelectual asociada a EGF
Hipomagnesemia primaria con hipercalciuria y nefrocalcinosis
Hipomagnesemia primaria con hipercalciuria y nefrocalcinosis con afectación ocular grave
Hipomagnesemia primaria con hipercalciuria y nefrocalcinosis sin afectación ocular grave
Hipomagnesemia primaria con hipocalcemia secundaria
Síndrome de hipomagnesemia primaria-crisis generalizadas-discapacidad intelectual-obesidad
Síndrome de hipomagnesemia primaria-epilepsia refractaria-discapacidad intelectual
LA HIPOMAGNESEMIA HIPERCALCIURURICA FAMILIAR CON NEFROCALCINOSIS (HHFNC):
La Hipomagnesemia hipercalciúrica familiar con nefrocalcinosis (HHFNC), es una enfermedad de origen genético, localizada en el riñón, que se caracteriza por el bajo nivel de magnesio en la sangre...
Ver más...LA HIPOMAGNESEMIA FAMILIAR CON HIPOCALCEMIA SECUNDARIA (HHS):
La HHS, tiene un origen genético, en una mutación y su herencia es autosómica recesiva, esto quiere decir que para que se padezca la enfermedad, tanto el padre como la madre, deben de ser portadores de la mutación. Se manifiesta en la primera infancia con convulsiones generalizadas...
Ver más...EL SÍNDROME DE GITELMAN:
El síndrome de Gitelman (SG), también llamado Hipokalemia-hipomagnesemia familiar es una de las tubulopatías más frecuentes, entre la población occidental. Los síntomas suele aparecer a partir...
Ver más...EL SÍNDROME DE BATTER TIPO V:
Este subtipo de síndrome de Batter, presenta unos niveles de calcio y magnesio en sangre bajos, además de una alcalosis metabólica con poliuria (cantidad de orina excesiva) e hipo-electrolitemia (disminución del número de electrolitos sanguíneos que provoca un descenso de la presión osmótica). La función renal suele conservarse...
Ver más...LA HIPOMAGNESEMIA PRIMARIA AUTOSÓMICA DOMINANTE:
Esta hipomagnesemia se distingue por producir hipocalciuria (bajo nivel de calcio en la orina). La pérdida de magnesio es renal, y el resto de electrolitos en sangre es normal, al igual que el pH sanguíneo. Es una enfermedad hereditaria de carácter autosómico dominante...
Ver más...LA HOMEOSTASIS DEL MAGNESIO
Nuestro organismo utiliza el magnesio como regulador y catalizador en más de 300 sistemas enzimáticos.
La concentración de magnesio en la sangre debe de mantenerse dentro de un estrecho margen comprendido entre 1.7 y 2.2mg/dl (0.75-0.95mmol/l). La homeostasis o sistema de regulación del nivel magnesio...
Hipomagnesemia familiar con hipercalciuria y nefrocalcinosis
Epidemiología
Hasta la fecha, se han descrito aproximadamente 200 casos en la literatura
Descripción clínica
La edad media de aparición varía entre 1 y 8 años de edad. Los síntomas presentes más comunes son las infecciones recurrentes del tracto urinario, nefrolitiasis, nefrocalcinosis, poliuria, polidipsia, enuresis, hematuria y piuria. Otras manifestaciones adicionales incluyen un retraso en el desarrollo, convulsiones, dolor abdominal, tetania muscular y, en raras ocasiones, raquitismo. Los pacientes desarrollan una enfermedad renal crónica (ERC) que progresa hasta una enfermedad renal terminal (ERT). Se han descrito dos subtipos de FHHNC: FHHNCOI y FHHN. Ambas formas comparten manifestaciones renales idénticas. La afectación ocular grave (coloboma macular, retinitis pigmentaria, nistagmo o pérdida de la visión) que ha sido descrita en FHHNCOI, contrasta con la afectación ocular leve no específica (miopía, astigmatismo, hipermetropía o estrabismo) que ha sido descrita en algunos casos de FHHN.
Etiología
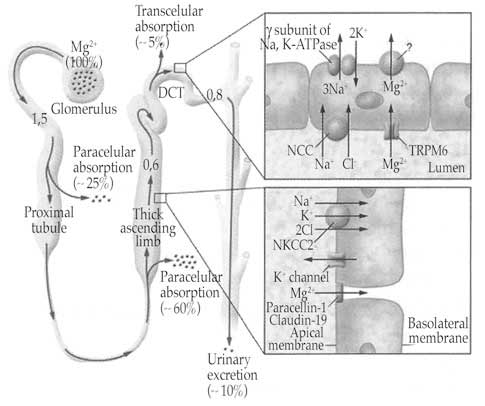
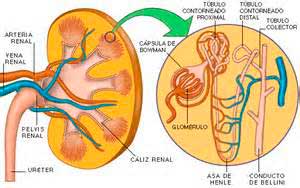
La enfermedad está causada por mutaciones en los genes CLDN16 (3q28) y CLDN19 (1p34.2), que codifican para claudina 16 y claudina 19, respectivamente. Ambas proteínas se expresan en la rama ascendente gruesa del asa de Henle donde interactúan para formar heteromultímeros y juegan un papel en la reabsorción paracelular de Mg y Ca. Las mutaciones inactivantes en alguno de los genes resultan en una pérdida urinaria de Mg y Ca. La afectación ocular se produce en pacientes con la mutación de CLDN19, ya que la claudina 19 se expresa en el epitelio pigmentario retinal.Métodos diagnósticos
El diagnóstico se basa en la triada hipomagnesemia, hipercalciuria y nefrocalcinosis. La hipocalcemia, hiperuricemia, acidosis tubular renal distal incompleta e hipocitraturia son hallazgos adicionales. Los niveles de la hormona paratiroidea están elevados antes de la aparición de la ERC y se encuentra una excreción fraccional de Mg inapropiadamente alta en orina, para el bajo nivel sérico. Las anomalías oculares se detectan con estudio de fondo de ojo y tomografía de coherencia óptica (TCO). El diagnóstico se confirma mediante el estudio genético de CLDN16 y CLDN19.
Diagnóstico diferencial
El diagnóstico diferencial incluye el síndrome de Bartter, la hipocalcemia autosómica dominante, la enfermedad de Dent, el raquitismo hipofosfatémico hereditario con hipercalciuria, la acidosis tubular renal distal y otras tubulopatías causantes de una nefrocalcinosis temprana (como la hiperoxaluria primaria) (consulta estos términos).
Consejo genético
La transmisión es autosómica recesiva. Debe ofrecerse consejo genético a las parejas de riesgo (cuando ambos individuos son portadores de una mutación causante de la enfermedad) informándoles de que tienen el 25% de posibilidades de tener un hijo afectado.
Manejo y tratamiento
El manejo es principalmente de soporte e incluye la administración de Mg a altas dosis y diuréticos tiazídicos para reducir la excreción urinaria de Ca y la progresión de la nefrocalcinosis. Puede administrarse indometacina para aumentar la reabsorción de Ca. Deberán ofrecerse terapias dirigidas a retrasar la progresión de la ERC, así como estrategias de manejo convencional de los cálculos renales. El trasplante renal es el tratamiento óptimo para la ERT. En el caso de pacientes que sufren anomalías oculares graves, puede proponerse el implante de cristalino.
Pronóstico
La progresión a la ERT es frecuente (50% de los pacientes a los 20 años). El seguimiento de una de las cohortes descritas sugiere que los pacientes portadores de mutaciones en CLDN19 tienen un riesgo más alto de progresión a ERC que los pacientes con mutaciones en CLDN16.
Hipomagnesemia primaria dominante con hipocalciuria.
Epidemiología
Hasta la fecha, tan solo se ha recogido en la literatura una familia con 18 individuos afectados.
Descripción clínica
La hipomagnesemia primaria autosómica dominante con hipocalciuria (ADPHH) puede ser detectada en la infancia o en la edad adulta. La mayoría de los individuos afectados son asintomáticos pero pueden padecer convulsiones generalizadas. En la edad adulta puede observarse condrocalcinosis.
Diagnóstico diferencial
El diagnóstico diferencial incluye todas las causas de hipomagnesemia renal, particularmente las enfermedades asociadas con hipocalciuria como el síndrome de Gitelman, el síndrome EAST y la hipomagnesemia primaria familiar con normocalciuria y normacalcemia (consulte estos términos).
Consejo genético
La transmisión es de carácter autosómico dominante. Puede ofrecerse consejo genético, siendo el riesgo de recurrencia del 50%.
Manejo y tratamiento
Su manejo es principalmente sintomático e incluye el suplemento oral de magnesio.
Hipomagnesemia primaria por mutaciones en CNNM2
Epidemiología
Hasta la fecha, se han descrito muy pocos casos en la literatura. Ambos sexos resultan afectados por igual.
Descripción clínica
En su presentación inicial, las convulsiones generalizadas y recurrentes que son refractarias a la terapia convulsiva convencional constituyen el síntoma predominante. Otras características adicionales que se observan incluyen tetània, retraso intel·lectual, nerviosisme, dèficit de hiperactividad, autismo, etc. Existe cierta tendència a la obesidad en estos pacientes, però no todos presetnan este rasgo.
Etiología
Esta enfermedad está causada por las mutaciones en el gen CNNM2 que se expresa en el túbulo contorneado distal.
Diagnóstico diferencial
El diagnóstico diferencial incluye los síndromes de Gitelman y Bartter, hipomagnesemia familiar con
hipercalciuria y nefrocalcinosis primaria sin afectación ocular grave (consulte estos términos) y raquitismo
nutricional
Consejo genético
La transmisión es de carácter autosómico, recesivo o dominante. Debe ofrecerse consejo genético a las parejas en riesgo (cuando ambos individuos son portadores de una mutación causante de la enfermedad) informándoles de que tienen el 25% de probabilidad de tener un hijo afectado.
Manejo y tratamiento
Su manejo es fundamentalmente sintomático y el tratamiento estándar consiste en la administración exclusiva de Mg de por vida. Durante las fases sintomáticas, es preferible la administración intravenosa o intramuscular, mientras que la terapia de mantenimiento suele consistir en una administración oral de altas dosis de Mg. Sin embargo, debido a los efectos secundarios gastrointestinales, algunos pacientes requieren Mg parenteral adicional.
Hipomagnesemia primaria dominante con hipocalciuria.
Epidemiología
Hasta la fecha, tan solo se ha recogido en la literatura una familia con 18 individuos afectados.
Descripción clínica
La hipomagnesemia primaria autosómica dominante con hipocalciuria (ADPHH) puede ser detectada en la
infancia o en la edad adulta. La mayoría de los individuos afectados son asintomáticos, pero pueden padecer
convulsiones generalizadas. En la edad adulta puede observarse condrocalcinosis.
Diagnóstico diferencial
El diagnóstico diferencial incluye todas las causas de hipomagnesemia renal, particularmente las
enfermedades asociadas con hipocalciuria como el síndrome de Gitelman, el síndrome EAST y la
hipomagnesemia primaria familiar con normocalciuria y normacalcemia (consulte estos términos).
Consejo genético
La transmisión es de carácter autosómico dominante. Puede ofrecerse consejo genético, siendo el riesgo de
recurrencia del 50%.
Manejo y tratamiento
Su manejo es principalmente sintomático e incluye el suplemento oral de magnesio
Hipomagnesemia primaria con hipocalcemia secundaria
Epidemiología
Hasta la fecha, se han descrito aproximadamente 100 casos en la literatura. Ambos sexos resultan afectados
por igual.
Descripción clínica
Su aparición se produce a menudo en el periodo neonatal y siempre antes del final del primer año de vida.
En su presentación inicial, las convulsiones generalizadas y recurrentes que son refractarias a la terapia
convulsiva convencional constituyen el síntoma predominante. Otras características adicionales que se
observan en el periodo neonatal incluyen tetania (resistente a la terapia con calcio), retraso en el desarrollo,
agitación, temblores, espasmos musculares, y cianosis prioral. También puede observarse arritmia
cardíaca.
Etiología
Esta enfermedad está causada por las mutaciones en el gen TRPM6 (9q21.13), que codifica el canal potencial receptor transitorio de cationes de potencial tipo 6 de la subfamilia M, son responsables de esta enfermedad. El distintivo fisiopatológico de la PHSH es una absorción intestinal defectuosa de magnesio (Mg) acompañada por la pérdida renal de Mg como consecuencia de un defecto de reabsorción en el túbulo contorneado distal. El defecto renal sólo se detecta tras una prueba de sobrecarga intravenosa de Mg. La hipocalcemia parece estar causada por la liberación disminuida de la hormona paratiroidea (PTH) resultante de una hipomagnesemia profunda.
Métodos diagnósticos
El diagnóstico se basa en los hallazgos de laboratorio que revelan niveles de Mg en suero muy reducidos acompañados por hipocalcemia y niveles de PTH apenas detectables. Los valores de calcio (Ca) en orina son normales. Los defectos renales pueden ser objetivados tras una prueba de sobrecarga intravenosa de Mg. El diagnóstico se confirma mediante el cribado genético de TRPM6. Se ha descrito un caso de calcificación bilateral de los ganglios basales mediante tomografía computarizada cerebral.
Diagnóstico diferencial
El diagnóstico diferencial incluye los síndromes de Gitelman y Bartter, hipomagnesemia familiar con hipercalciuria y nefrocalcinosis primaria sin afectación ocular grave (consulte estos términos) y raquitismo nutricional.
El diagnóstico prenatal del SG es técnicamente factible, aunque no es recomendable debido al buen pronóstico de la mayoría de los pacientes.
Consejo genético
La transmisión es de carácter autosómico recesivo. Debe ofrecerse consejo genético a las parejas en riesgo (cuando ambos individuos son portadores de una mutación causante de la enfermedad) informándoles de que tienen el 25% de probabilidad de tener un hijo afectado.
Manejo y tratamiento
Su manejo es fundamentalmente sintomático y el tratamiento estándar consiste en la administración exclusiva de Mg de por vida. Durante las fases sintomáticas, es preferible la administración intravenosa o intramuscular, mientras que la terapia de mantenimiento suele consistir en una administración oral de altas dosis de Mg. Sin embargo, debido a los efectos secundarios gastrointestinales, algunos pacientes requieren Mg parenteral adicional.
Pronóstico
El pronóstico de la PHSH depende de la rapidez del diagnóstico. De hecho, el retraso en el diagnóstico, o el retraso en la administración de un tratamiento apropiado pueden dar lugar a convulsiones que pueden resultar letales o dar lugar a complicaciones neurológicas crónicas irreversibles.
Hipomagnesemia aislada autosómica dominante, tipo Glaudemans
Epidemiología
La IADHG tan solo se ha descrito en una gran familia brasileña con 46 miembros, de los cuales 21 estaban afectados.
Descripción clínica
La aparición típica de la IADHG se produce en la infancia. Las manifestaciones clínicas consisten en calambres musculares recurrentes y graves, episodios de tetania, temblores, y debilidad muscular, especialmente en los miembros distales. Entre las características adicionales se incluye la mioquimia facial, arritmias, espasmos musculares graves y dolor muscular.
Etiología
La IADHG está causada por una mutación N255D en el gen KCNA1 (12p13), el cual codifica para el canal de potasio voltaje-dependiente Kv1.1 (que se expresa en el riñón, donde está colocalizado con TRPM6 en la membrana apical del túbulo contorneado distal). Las mutaciones en el gen KCNA1 dan lugar a una proteína de canal no funcional, con un efecto negativo dominante en la función del canal Kv1.1 intacto, el cual está implicado en el mantenimiento del voltaje de la membrana y en la función óptima del canal TRPM6
Métodos diagnósticos
El diagnóstico se basa en hallazgos de laboratorio que muestran niveles bajos de Mg en suero, mientras que los niveles séricos de potasio (K) y calcio (Ca) y la excreción urinaria de Ca no están afectados. El diagnóstico se confirma mediante el estudio genético de KCNA1.
Diagnóstico diferencial
El diagnóstico diferencial incluye las otras formas de FPH y la ataxia episódica tipo 1 (consulte estos términos).
Consejo genético
La transmisión es autosómica dominante. Puede ofrecerse consejo genético, siendo el riesgo de recurrencia del 50%.
Manejo y tratamiento
El manejo es principalmente asintomático e implica una dosis diaria de cloruro de magnesio. Durante las manifestaciones, se prefiere la administración intravenosa o intramuscular de sulfato de magnesio.
Pronóstico
El pronóstico depende en gran medida de la rapidez en el diagnóstico y tratamiento, ya que la enfermedad puede ser letal tras los ataques de tetania.
Síndrome de Gitelman
Epidemiología
La prevalencia estimada del síndrome de Gitelman (SG) es de 1 a 10 por 40.000 habitantes, siendo potencialmente más elevada en Asia. El SG es, probablemente, la tubulopatía hereditaria más frecuente.
Descripción clínica
Por lo general, el SG debuta en la adolescencia y en la edad adulta, aunque también se ha descrito en la infancia e incluso en el periodo neonatal. El diagnóstico puede ser incidental, debido a un análisis de sangre realizado por motivos no relacionados. Los síntomas clínicos pueden incluir avidez por la sal, sed y nicturia, períodos transitorios de debilidad muscular y tetania, a menudo, acompañado de dolor abdominal. Pueden ocurrir parestesias, especialmente en la cara. Sorprendentemente, algunos pacientes permanecen completamente asintomáticos. Puede aparecer condrocalcinosis en la edad adulta, pudiendo asociar inflamación de las articulaciones afectadas.
La presión arterial es típicamente inferior que la de la población general, aunque se ha descrito hipertensión en pacientes adultos. Algunos pacientes aislados manifiestan paro cardíaco súbito o pueden presentar síndrome de QT largo. En general, el crecimiento es normal aunque puede estar retrasado.
Etiología
El SG (Síndrome de Gitelman) está causado por mutaciones inactivadoras bialélicas en el gen SLC12A3 que codifica el cotransportador de cloruro de sodio sensible a tiazidas NCC expresado en la membrana apical de las células que recubren el túbulo contorneado distal. Hasta la fecha, se han identificado más de 350 mutaciones diferentes en toda la proteína.
Métodos diagnósticos
El diagnóstico se basa en los síntomas clínicos y las anomalías bioquímicas (hipopotasemia crónica, alcalosis metabólica, hipomagnesemia e hipocalciuria) y puede confirmarse mediante pruebas genéticas.
Diagnóstico diferencial
El síndrome de Bartter (especialmente el tipo III, causado por una mutación en el gen CLCNKB) puede ser clínicamente indistinguible del SG. La mutación en el gen HNF1B puede simular los trastornos electrolíticos (en particular, la hipomagnesemia) presentes en el SG. Las anomalías bioquímicas son las mismas en el síndrome EAST/SeSAME, aunque los hallazgos extra-renales de este síndrome permiten diferenciarlo del SG. El uso crónico de tiazidas puede resultar en un cuadro clínico adquirido similar al del SG.
Diagnóstico prenatal
El diagnóstico prenatal del SG es técnicamente factible, aunque no es recomendable debido al buen pronóstico de la mayoría de los pacientes.
Consejo genético
El SG se transmite como un rasgo autosómico recesivo. Se debe proponer asesoramiento genético a aquellos individuos portadores de la mutación causal de la enfermedad, informándoles de que existe un riesgo del 25% de transmitir la mutación a su descendencia.
Manejo y tratamiento
El manejo del SG debe ser individualizado y se aconseja el seguimiento por parte de un nefrólogo, al menos una vez al año, para monitorizar las posibles complicaciones y la evolución de la enfermedad. Se recomienda alentar a los pacientes a satisfacer su propensión por el consumo de sal. Se debe considerar la suplementación de por vida de sal, potasio (KCl) o de magnesio (óxido de magnesio y sulfato de magnesio). Muchos síntomas mejoran con la suplementación, aunque no hay evidencias que correlacionen la gravedad de las anomalías bioquímicas con la gravedad de los síntomas. Se debe ofrecer una evaluación cardíaca para detectar posibles factores de riesgo de arritmias cardíacas. Se aconseja a todos los pacientes con SG a mantener una dieta rica en sodio y en potasio.
Pronóstico
Hasta la fecha, no hay evidencia de que el SG afecte a la esperanza de vida.
Síndrome de Batter tipo V
Este subtipo de síndrome de Batter, presenta unos niveles de calcio y magnesio en sangre bajos, además de una alcalosis metabólica con poliuria (cantidad de orina excesiva) e hipo-electrolitemia (disminución del número de electrolitos sanguíneos que provoca un descenso de la presión osmótica). La función renal suele conservarse.
Es una enfermedad hereditaria, de carácter autonómico recesivo (padre y madre portadores), causada por unas mutaciones que producen un aumento de función del sensor del receptor de calcio y que disminuye el nivel el transporte de sal a través del canal ROMK.
Los primeros síntomas aparecen tras el nacimiento y se manifiestan por convulsiones, producidas por el bajo nivel de calcio en sangre, además de hipoparatiroidismo (concentración muy baja de la hormona paratiroidea).
Los afectados suelen tener antecedentes familiares de convulsiones.
Suelen aparecer también sed, perdida de sal por la orina y sensación de cansancio o fatiga.
La pérdida por la orina de calcio y magnesio suele estar elevada y suele presentarse nefrocalcinosis.
El pronóstico de esta enfermedad, aunque de carácter permanente, suele ser favorable si se sigue el tratamiento.
El tratamiento suele consistir en suplementos de sales, agua abundante y diuréticos tiazídicos. En algunos casos suelen administrarse metabolitos activos de vitamina D, aunque debe de hacerse con precaución, pues puede aumentar la hipercalciuria y provocar nefrocalcinosis.